Datos Farmacocinéticos (PK) y
Datos Farmacodinámicos (PD)
Diseño de ensayo:
Estudio aleatorizado, doble ciego, unicéntrico, de una dosis, controlado con principio activo, con pinzamiento normoglucémico, cruzado, con 3 grupos.
Criterio de evaluación principal:
Área bajo la curva de la concentración de insulina en plasma (AUCins.0-30h)
Concentración máxima de insulina (Cins.max)
Criterio de evaluación secundario:
AUCins.0-6h, AUCins.6-30h, AUCins.0-∞, tmax, t1/2, constante de eliminación terminal (λz).
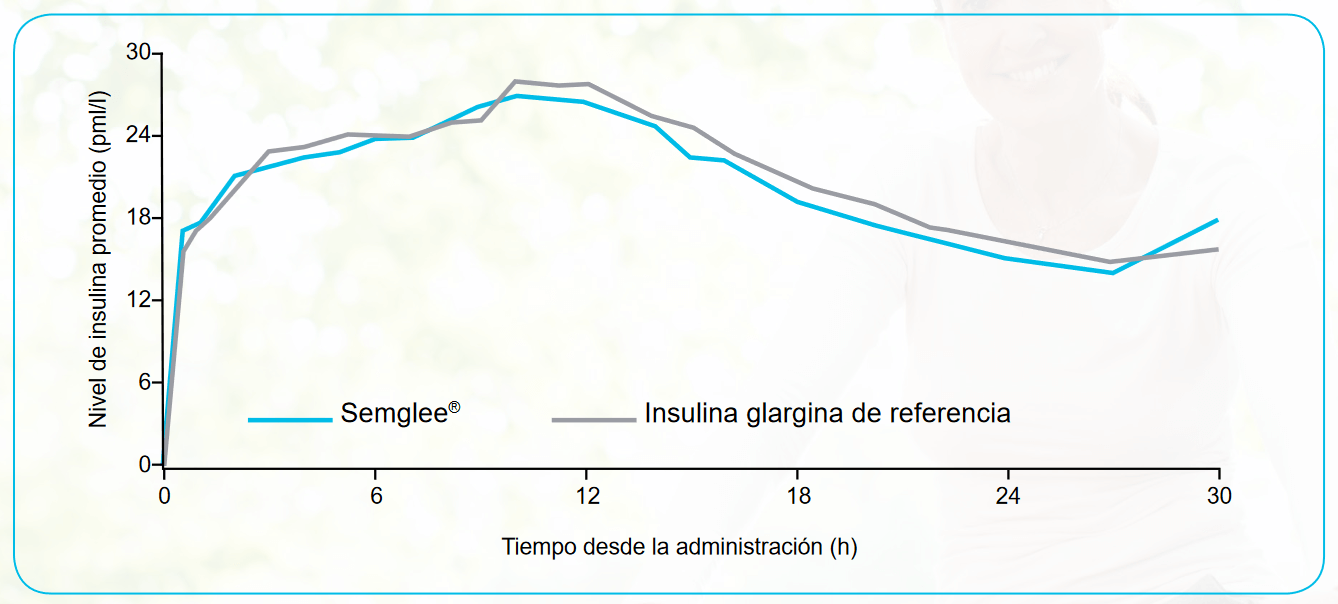
Se observaron niveles de Semglee® y de la IG de referencia en la sangre durante por lo menos 24 horas después de la inyección y alcanzaron concentraciones máximas equivalentes.
En un estudio de una dosis y con pinzamiento normoglucémico, que incluyó a 114 pacientes con diabetes de tipo 1, Semglee® demostró un perfil farmacocinético equivalente al de la IG de referencia.
AUCins: Área bajo la curva de la concentración de insulina en plasma
Los resultados de los estudios farmacocinéticos demuestran una bioequivalencia con la insulina glargina (IG) de referencia.14
14. European Medicines Agency (EMA). Assessment report: Semglee (2018). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_ library/EPAR_-_Public_assessment_report/human/004280/WC500249349.pdf
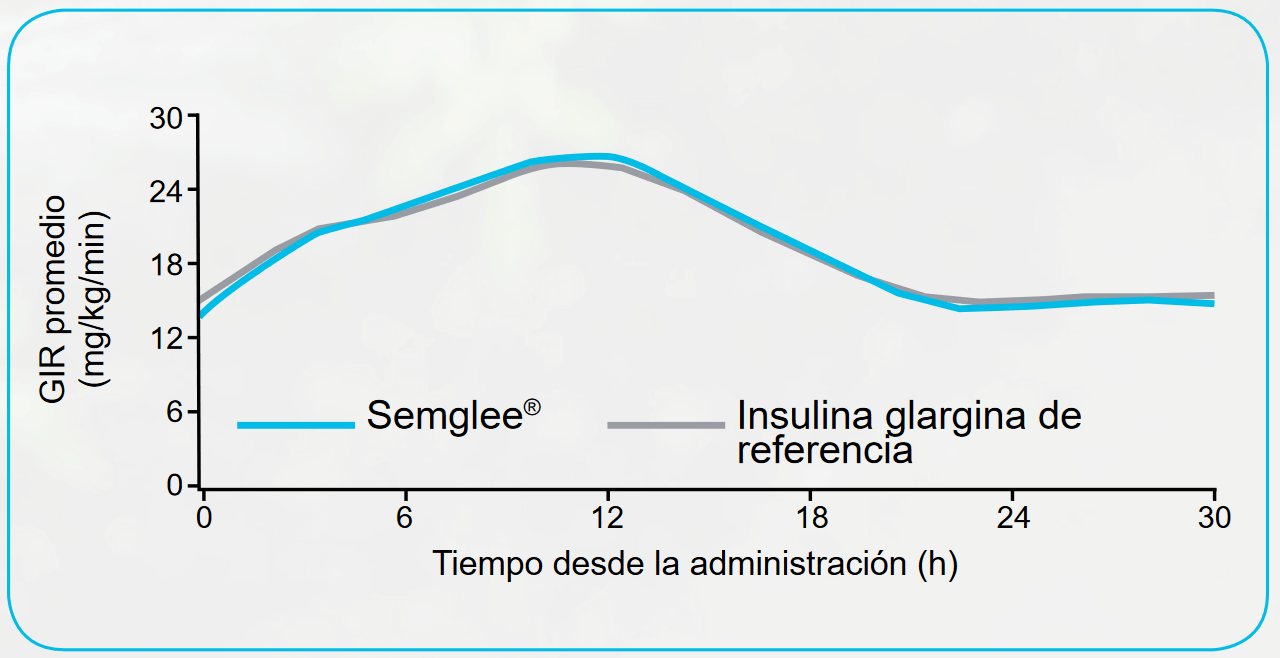
La farmacodinámica clínica respalda el perfil farmacocinético y la conclusión de que el producto tiene una biosimilitud con la IG de referencia.14
La acción de reducción de la glucosa, según el perfil farmacocinético -tasa de infusión de glucosa (GIR) 30 horas después de la inyección- se consideró el criterio de evaluación secundario.
La GIR después de la administración de una inyección de Semglee® y de la IG de referencia demostró una evolución temporal semejante (perfiles de baja respuesta con AUC GIR0-30 ≤ 50 [h*mg/kg/min] excluido).
14. European Medicines Agency (EMA). Assessment report: Semglee (2018). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_ library/EPAR_-_Public_assessment_report/human/004280/WC500249349.pdf