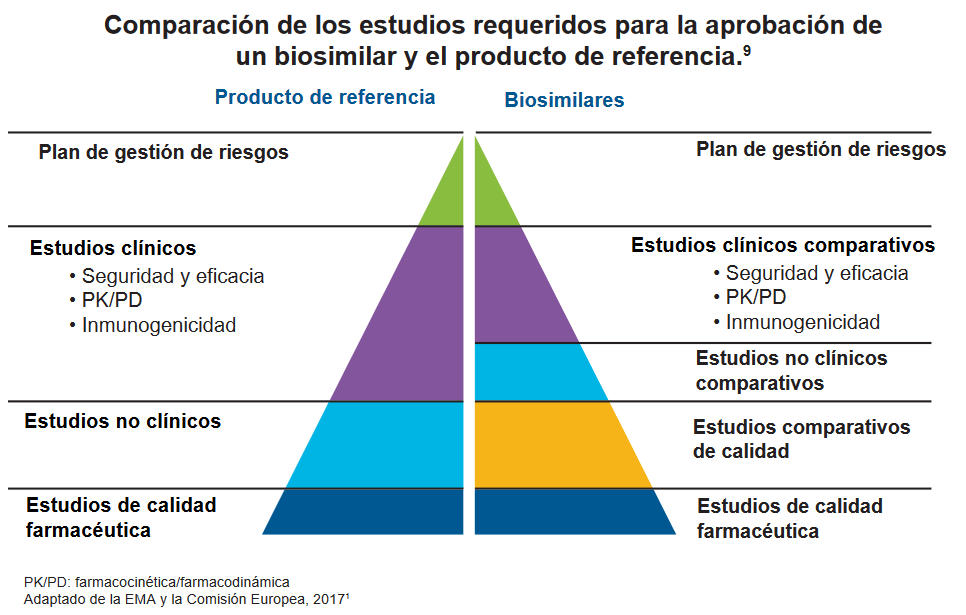
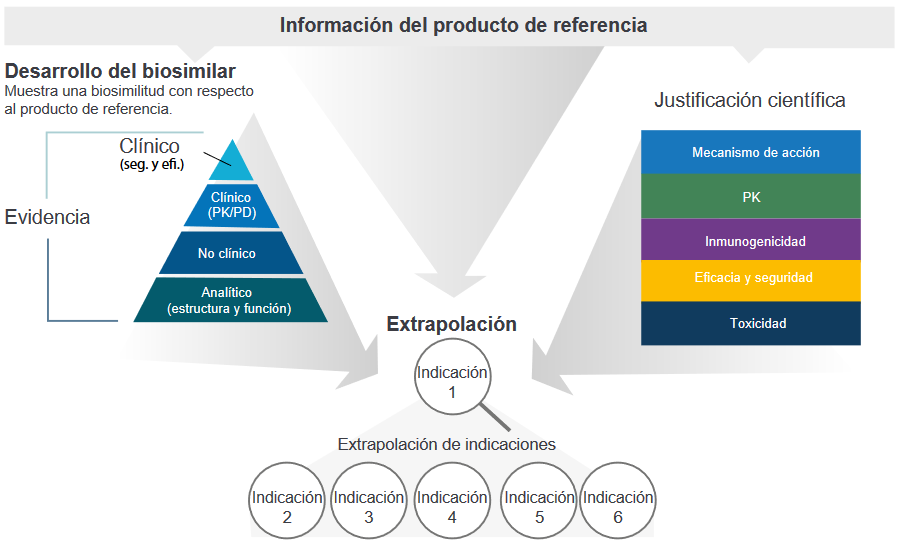
Proceso de aprobación de los biosimilares
1. Gherghescu, I.; Delgado-Charro, M.B. The Biosimilar Landscape: An Overview of Regulatory Approvals by the EMA and FDA. Pharmaceutics 2021, 13, 48. https://doi.org/10.3390/pharmaceutics13010048
9. European Medicines Agency & European Commission. Biosimilars in the EU. Information guide for healthcare professionals (2017). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Leaflet/2017/05/WC500226648.pdf
La extrapolación de las indicaciones para un biosimilar propuesto se basa en la información del producto de referencia y en una justificación científica.10
10. Thill M, Thatcher N, Hanes V, Lyman GH. Biosimilars: what the oncologist should know. Future Oncol. 2019 Apr;15(10):1147-1165. doi: 10.2217/fon-2018-0728. Epub 2019 Feb 22. PMID:30793950.